Zytogenetik
Folgende Diagnostik bieten wir
Hämatologische Erkrankungen sind gekennzeichnet durch das Auftreten erworbener genetischer Veränderungen, die klonal in den malignen Zellen vorliegen. Diese Veränderungen spielen eine große Rolle bei der Diagnosesicherung, Prognose, der Risikostratifizierung und der Behandlung.
Chromosomenbänderungsanalyse (G-Banding)
Die Zytogenetik ermöglicht das Identifizieren von nummerischen und strukturellen Veränderungen der DNA auf Chromosomenebene. Die zu untersuchenden Zellen aus Knochenmark oder peripherem Blut werden für 24 bis 72 Stunden in Kultur gebracht und mit unterschiedlichen „Zytokin-Cocktails“ für optimales Wachstum versehen. Durch die Zugabe des Zellgiftes Colcemid am Ende der Kultivierungsphase wird der Zellzyklus in der Metaphase arretiert. Dabei liegen die Chromosomen in der höchst kondensierten Form vor. Nach der Fixierung in Methanol:Eisessig 3:1 wird die Suspension auf einen Objektträger getropft und für weite Untersuchungen verwendet.
Bei der konventionellen Zytogenetik werden die Chromosomen lichtmikroskopisch analysiert. Durch den Einsatz bestimmter Pufferlösungen und Färbetechniken, wie der Giemsa-Färbung, entsteht ein typisches Bandenmuster, welches für jedes Chromosom spezifisch ist und die eindeutige Zuordnung der Homologen nach Größe, Lage des Zentromers und der Banden erlaubt (Bild 1a).
Mikroskopische nummerische (z. B. Monosomien oder Trisomien) und strukturelle Veränderungen (z. B. Translokationen, Deletionen, Inversionen) können anhand des Karyogramms identifiziert werden (Bild 1b).

FISH
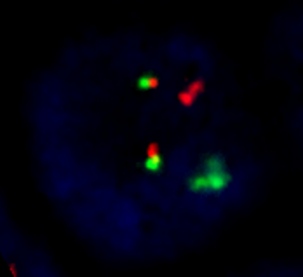
Eine wichtige Methode in der Zytogenetik stellt die Fluoreszenz In Situ Hybridisierung (FISH) dar. Sie erlaubt, dass bestimmte Chromosomenbereiche (Gene/Genloci) mittels fluoreszenzmarkierten Sonden gezielt in Interphasekernen oder auf Chromosomen der Metaphase detektiert werden. Mit dieser Methode ist es möglich, submikroskopische oder kryptische Veränderungen (z.B Deletionen, Insertionen) zu detektieren. Dabei bindet die gewünschte Sonde an denaturierte Ziel-DNA. Die Präparate werden mit DAPI gegengefärbt und im Fluoreszenzmikroskop auf das Vorhandensein der Signale oder die Lage der Signale auf den Präparaten beurteilt.
Unser Labor bietet folgende FISH-Diagnostik in der Routine an:
1. I-FISH
Bei der Interphase-FISH werden die nicht proliferierenden Zellen analysiert. Der Einsatz eines speziellen FISH Panels ermöglicht die parallele Analyse der häufigsten genetischen Veränderungen unterschiedlicher hämatologischer Systemerkrankungen aus der Zellkultur oder an immunologisch angereicherten mononukleären Zellen aus Knochenmark oder/und peripherem Blut.
2.„Schnell“-FISH
Hierbei handelt es sich um eine Interphase-FISH, die z. B. bei Verdacht auf ALL (BCR/ABL) oder AML M3 (PML/RARA) durchgeführtwerden kann. Die Auswertung der Sonden kann innerhalb von 3-4 Stunden erfolgen, so dass noch am Tag des Eintreffens der Probe im Labor eine Philadelphia-positive ALL oder eine AML M3 oder AL MrV bestätigt oder ausgeschlossen werden kann.
3. CID-FISH
Bei der Cell Identity-FISH-Analyse wird die gewünschte Sonde an die Metaphasechromosomen hybridisiert. Die CID-FISH wird zu Unterstützung der konventionellen Zytogenetik durchgeführt, um zusätzlich gefundene Anomalien zu bestätigen oder zu wiederlegen.
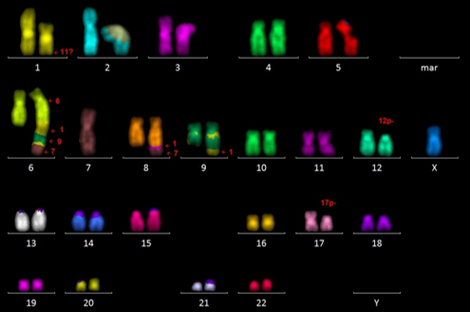
Eine besondere Form der CID-FISH ist die Multiplex-FISH (oder 24 Farben FISH). Diese Methode erlaubt es, dass alle 46 Chromosomen in einer Hybridisierung „angefärbt“ werden. Dabei wird jedes Chromosom anhand unterschiedlich eingesetzter Kombinationen von Fluorophoren eindeutig identifiziert. Mit diesem Verfahren werden unbalancierte Translokationen und/oder komplexe Karyotypen aufgeschlüsselt (s. Abbildung).
MACS
Gezielte Anreicherung von Zellen aus dem Blut und Knochenmark
Maligne hämatologische Erkrankungen entstehen in der Regel aus einer bestimmten hämatopoetischen Zellpopulation, die durch bestimmte Oberflächenmarker charakterisiert sind. Die immunomagnetische Anreicherung mittels MACS (Magnetic-activated cell sorting) erlaubt die spezifische Untersuchung dieser betroffenen Zellen. Dabei werden die Zellen mit entsprechenden Antikörpern (z.B. CD3 für T-Zellen, CD34 für Vorläuferzellen, CD138 für Plasmazellen), die an magnetische Partikel (Microbeads) gebunden sind über eine Säule, die sich in einem magnetischen Feld befindet, angereichert.Positiv markierte Zellen werden in der Trennsäule zurückgehalten, während die Negativfraktion als Durchlauf erscheint. Wird die Säule aus dem Magnetfeld entfernt, lassen sich die markierten Zellen als Positivfraktion eluieren. Diese Methode erlaubt –abhängig vom Antigen- eine Anreicherung von 40-90%.
Das könnte Sie auch interessieren